LA NUTRIZIONE DEI LIEVITI FAVORISCE I BATTERI
La nutrizione azotata in enologia è una pratica consolidata che mira ad ottenere un vino più pulito, tuttavia essa può portare a dei paradossi nello stato nutrizionale del vino finito e in definitiva a delle alterazioni nelle sue caratteristiche organolettiche.
Mantenere al livello più basso possibile l’azoto α-amminico, monitorandolo non solo durante la fermentazione, ma anche nella fase post-fermentativa.
Valutare con microscopio la presenza di batteri lattici che sono conseguenza diretta del tenore in azoto α-amminico via via crescente dopo la fine della fermentazione alcolica.
LIEVITI E MITOCONDRI IN SOLUZIONI ZUCCHERINE
I lieviti come noto fermentano il glucosio ma possiedono i mitocondri che sono organelli deputati alla produzione di energia per via respiratoria. In presenza di glucosio il metabolismo respiratorio viene inibito ma i mitocondri mantengono alcune funzionalità derivate dallo svolgimento parziale del ciclo di Krebs, quali la produzione di acido 2-osso-glutarico (α-cheto-glutarico) che permette l’organicazione dello ione ammonio e di acido succinico che ha un ruolo importante nell’innalzamento dell’acidità dei vini.
I lieviti sono organismi unicellulari eucarioti e in questa sede desidero innanzitutto analizzare brevemente il percorso evolutivo che ha condotto a tali cellule fungine.
In origine tutte le forme di vita erano cellule procariotiche ovvero cellule nelle quali il DNA non era compartimentato in un nucleo. Tali cellule esistono ancora oggi e sono gli eubatteri e gli archeobatteri.
Nel tempo, e parliamo di circa 1,7 miliardi di anni fa, alcune cellule procariotiche hanno racchiuso il DNA all’interno di una membrana a base fosfolipidica, sterolica e proteica, strutturalmente analoga alla membrana che circonda il citoplasma. In un secondo tempo queste cellule hanno inglobato cellule di minori dimensioni chiamate α-protobatteri, che si sono comportati da endosimbionti: è questo il caso dei mitocondri che sono stati “inglobati” all’interno del citoplasma della cellula “ospite” portando in dote la loro formidabile capacità di produrre energia dai prodotti della glicolisi, tramite due passaggi metabolici di enorme importanza: il ciclo di Krebs e la fosforilazione ossidativa. Nei lieviti il 15% del DNA totale è DNA mitocondriale. (Carl Malina, Christer Larsson, Jens Nielsen, 2018).
Questa simbiosi ha creato le attuali cellule eucariotiche tra cui Saccharomyces cerevisiae. Noi siamo tradizionalmente abituati a considerare il lievito come un fermento ma questa definizione è riduttiva e non giustificherebbe la presenza dei mitocondri che hanno una funzione respiratoria.
In condizioni aerobie e con bassissimi tenori di glucosio il lievito infatti respira: la respirazione gli consente di produrre un alto tenore di ATP, ovvero circa 36 moli di ATP per ogni mole di glucosio.
Ma non appena il lievito si trova in soluzioni lievemente zuccherine (8 g/L secondo il dottor Herbert G. Crabtree) i mitocondri vengono inibiti. Che significa ciò? I mitocondri non scompaiono dal lievito, semplicemente non riescono a sintetizzare le proteine, ovvero gli enzimi che producono l’ATP nella catena di ossidazione del NADH,H+ e del FADH2, ovvero la fosforilazione ossidativa.
Ma nella condizione fermentativa cosa accade al ciclo di Krebs?
Il ciclo di Krebs è certamente inibito dal glucosio ma è evidente come una serie di passi metabolici avvengano nei mitocondri anche durante la fermentazione. Infatti nel corso della fermentazione l’esistenza di alcune molecole del ciclo di Krebs è assolutamente dimostrata. (Carl Malina, Rosemary Yu, Johan Björkeroth, Eduard J. Kerkhoven, Jens Nielsen, 2021).
Una di queste molecole è l’acido 2-osso-glutarico (α-chetoglutarico nella versione arcaica) senza il quale non vi sarebbe l’organicazione dello ione ammonio nella posizione 2 con formazione del glutammato, amminoacido che è la base per la sintesi proteica. Tale reazione ha un risvolto pratico ben noto: se infatti non ci fosse l’acido 2-osso-glutarico la nutrizione tramite sali ammoniacali (quali il DAP) non darebbe risultati, in quanto l’ammonio resterebbe inutilizzato: questa reazione è mostrata nella figura sottostante
Possiamo dunque affermare che in presenza di glucosio il ruolo dei mitocondri non è del tutto inibito. Vi è anzi un altro passaggio metabolico che richiede l’attività dei mitocondri e coinvolge ancora una volta l’acido 2-osso-glutarico all’interno della fase iniziale del ciclo di Krebs.
E’ noto che i lieviti durante la fermentazione producono acido succinico in quantità rilevanti e l’acido succinico si origina appunto dall’acido 2-osso-glutarico, come mostrato nella figura a seguito.
L’effetto principale che il glucosio esplica sulla repressione dell’attività mitocondriale (effetto Crabtree) è certamente quella di inibire completamente la trascrizione del DNA mitocondriale, impedendo la sintesi degli enzimi necessari alla fosforilazione ossidativa.
È da sfatare la convinzione che fornendo una grande quantità di ossigeno durante le prime fasi della fermentazione, o nella preparazione del pied de cuve, si possa ottenere una certa attività respiratoria. In nessuna matrice vinica sarà mai possibile che i mitocondri svolgano la loro funzione principale, ovvero produrre ATP. È vero però che una ossigenazione importante specialmente nella preparazione del pied de cuve può migliorare la funzionalità di membrana dei mitocondri, così come la funzionalità di membrana di Saccharomyces cerevisiae; questo però è dovuto alla insaturazione degli acidi grassi e allo stimolo alla formazione di ergosterolo.
Per concludere è da rilevare il fatto che in condizioni fermentative a causa dell’effetto Crabtree i mitocondri perdono la facoltà di sintetizzare amminoacidi, il che rende il lievito completamente dipendente dall’azoto che trova nel mezzo fermentativo e ovviamente dall’azoto fornito dall’enologo sia nelle forme saline che organiche. L’effetto Crabtree porta dunque ad una grande perdita nelle funzionalità di Saccharomyces cerevisiae, ma i suoi effetti negativi sono controbilanciati da una capacità di consumo del glucosio molto maggiore rispetto ai ceppi Crabtree negativi. Tema di cui sarà interessante parlare in un prossimo futuro.
FERMENTAZIONE ALCOLICA IN ASSENZA DI SOLFITI
Una pratica consolidata in cantina quanto nefasta per la salute del consumatore è l’aggiunta di solfiti ai mosti e ai vini. Eppure ad oggi, anno domini 2024, i solfiti continuano ad essere utilizzati. Molte soluzioni alternative al loro utilizzo sono state proposte ma nessuna ha permesso di eliminarli del tutto; Il motivo è semplice: nessuna molecola, nessun additivo esercita la duplice funzione di antisettico e di antiossidante.
Antisettici ne sono stati proposti tanti: il sorbato di potassio, il dimetildicarbonato, l’acido fumarico, il lisozima, il chitosano. Ma tutti hanno un punto debole, per cui il risultato è che vengono affiancati ai solfiti senza sostituirli.
Di antiossidanti ne sono pure stati pure proposti tanti, ma spesso il risultato è stato addirittura dannoso per il profilo organolettico dei vini. Il tannino gallico, l’acido ascorbico, il glutatione si sono più volte rivelati falsi amici dell’enologo senza l’adeguata copertura con i solfiti.
La volontà insomma c’è stata, ma a tutt’oggi i solfiti dominano ancora la pratica enologica; l’alternativa ai solfiti, detto brutalmente sono l’ossidazione e/o l’alterazione microbiologica.
Potremmo forse ipotizzare di produrre un vino senza solfiti e scrivere la data di scadenza, ma sarebbe un semplice palliativo che andrebbe a detrimento del concetto di longevità che è necessario ad un vino di pregio.
L’abilità dell’enologo può essere quella di riuscire ad eliminare i solfiti aggiunti prima della fermentazione alcolica che vanno a costituire la SO2 combinata, mantenendo solamente i solfiti realmente attivi, che svolgono il reale effetto antisettico ed antiossidante.
Questo è possibile farlo solo se fino al termine della fermentazione alcolica si usano tecniche alternative ai solfiti per salvaguardare il mosto da ossidazioni e contaminazioni.
La migliore tecnologia che mi viene in mente è l’utilizzo delle basse temperature.
Le basse temperature hanno il pregio di essere un parametro reversibile, a differenza dei solfiti che una volta aggiunti, non si possono togliere. Non ho scoperto nulla di nuovo, il freddo in enologia si usa da 50 anni. Ma finora è sempre stato per lo più abbinato ai solfiti.
Ma che nemici voglio sconfiggere con il freddo?
Principalmente tre.
1. Gli enzimi ossidasici
2. I batteri lattici
3. I lieviti spontanei (principalmente i NON-Saccharomyces)
Tutti questi nemici sono gestibili con le basse temperature.
Il punto è: come individuare la soglia termica di efficacia?
2°C è il limite minimo per l’attività metabolica dei batteri lattici (Lactobacillus brevis, Oenococcus oeni).
5°C è il limite minimo per l’attività metabolica dei lieviti e col termine lieviti includo anche Brettanomyces bruxellensis/ Dekkera bruxellensis.
2°C è il limite minimo di azione della polifenolossidasi (tirosinasi)
Alla temperatura di 2°C non si verifica nessuna azione germicida e gli enzimi non vengono intaccati: è notorio che sia i batteri che i lieviti possono essere tranquillamente congelati a -18°C senza perdere la loro vitalità; a maggior ragione ciò vale per gli enzimi; solo a temperature di -30°C si ha la completa denaturazione di gran parte dei micororganismi di interesse enologico. Non dobbiamo dunque preoccuparci della perdita di attività né della perdita di alcuna molecola organica nell’intervallo tra 0 e 2°C.
Le uve alla raccolta hanno una temperatura variabile tra i 15 e i 30°C, perciò devono essere portate rapidamente a 2°C mentre sono ancora integre ponendole in ambienti refrigerati.
La pigiatura può avvenire solo dopo che i grappoli abbiano raggiunto stabilmente la temperatura di 2°C; l’ideale sarebbe porre la pigiatrice in cella frigo, nella quasi totale assenza di luce, il minimo indispensabile per l’operatività.
Il contatto del pigiato con l’ossigeno in condizioni di scarsa luminosità e di temperatura di 2°C non è un fattore di ossidazione, poiché la tirosinasi a 2°C non agisce.
La fase di macerazione pellicolare che segue alla pigiatura viene svolta a 2°C, possibilmente anche a 0°C: in queste condizioni la flora batterica e i lieviti di buccia non hanno alcuna possibilità di replicarsi.
Siccome la temperatura del pigiato è difficilmente omogeneizzabile bisogna porre la massima attenzione a monitorare la temperatura nella parte alta del recipiente: è proprio in questa zona che è necessario verificare che la temperatura non superi i 2°C, dato che è la zona che tende a scaldarsi prima ed è la zona in cui il pigiato è a contatto con l’ambiente esterno, contaminante per eccellenza. Come esplicato nello schema sottostante la temperatura nella zona superiore del serbatoio è di diversi gradi più calda rispetto alla parte bassa, che solitamente viene monitorata.
La pressatura a 2°C consente di agire a pressioni elevate, dato che non vi è rischio di estrarre polifenoli ossidanti: l’estrazione delle catechine e degli acidi fenoloci non è particolarmente alta a queste temperature, dato che la loro solubilità in soluzione acquosa è direttamente proporzionale alla temperatura; le pressioni elevate consentono di aumentare l’estrazione delle componenti azotate, dei terpeni, dei norisoprenoidi e dei composti carbonilici α-β insaturi, precursori di alcuni importanti tioli; infine si auspica una maggiore estrazione degli acidi grassi di e tri insaturi, tema ancora poco studiato ma i cui sviluppi sono di particolare interesse.
Il mosto ottenuto dalla pressa potrebbe necessitare una ulteriore refrigerazione, riportandolo a temperature prossime agli 0°C; è necessario trasferire il mosto in un serbatoio di acciaio coibentato e dotato di refrigerazione, colmo con anidride carbonica, che in questa fase è certamente il miglior gas inertizzante, grazie alla sua spiccata polarità che lo rende adeso al solvente (acqua). Il serbatoio di sosta del mosto deve essere interamente riempito dal succo.
Una sosta a freddo nel serbatoio coibentato è sempre preferibile, avendo cura di monitorare tramite microscopio i batteri e i lieviti presenti, con cadenza giornaliera.
La temperatura tenderà naturalmente a stratificare, con la parte alta del serbatoio in cui le temperature potrebbero salire di molto: ciò è un fattore di rischio per cui è necessario monitorare la temperatura del pelo del liquido almeno mattina e sera, operando una miscelazione della massa per ripristinare l’uniformità termica. E’ superfluo invece monitorare l’ossigeno, in quanto nel mosto l’ossigeno non è mai presente in forma libera ma sempre legato ad accettori del più vario tipo principalmente poli-idrossi-aldeidi (ossidazione del glucosio ad acido gluconico), come mostrato in figura sottostante.
Nel momento in cui si vorrà spillare il mosto da mettere in fermentazione si opererà una centrifugazione che permetterà di scegliere la torbidità ideale a cui condurre la fermentazione: il range consigliato è da 300 a 500 NTU.
L’inoculo del lievito può essere preparato il giorno prima della spillatura; è importante produrre un piede in attiva fermentazione, con molte gemme ed una popolazione di oltre 100.000 cellule attive/mL.
Il mosto da inoculare deve essere rapidamente portato dai 2 ai 18°C di modo che il lievito possa nel minor tempo possibile iniziare il consumo dell’azoto ammoniacale; tale azoto viene organicato sull’acido α-cheto-glutarico inserendolo sul carbonio carbonilico per sostituzione dell’ossigeno con l’azoto, come mostrato in figura sottostante.
Al consumo dell’azoto ammoniacale segue il consumo degli amminoacidi il che inibisce lo sviluppo dei batteri lattici (precedentemente bloccati dal freddo).
Durante la fermentazione alcolica il livello dei solfiti totali può essere incrementato da Saccharomyces cerevisiae; per questo motivo nei mosti non devono esserci precursori (zolfo elementare).
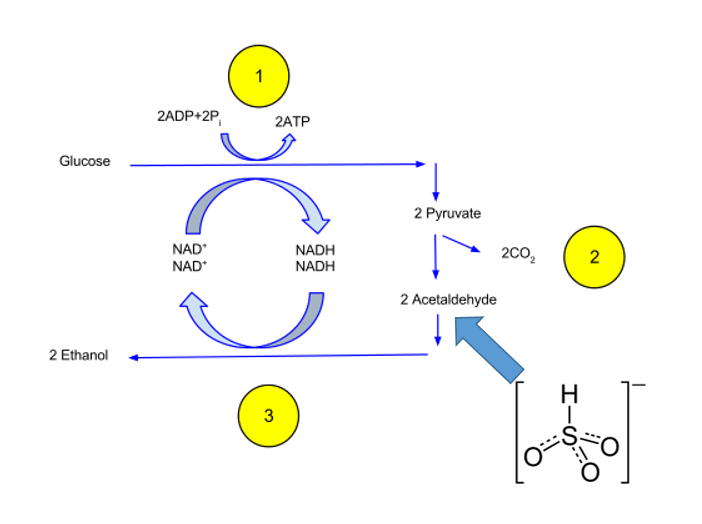
La fermentazione alcolica non è altro che una riduzione di una aldeide in cui il carbonio ha numero di ossidazione zero (ovvero il glucosio) in un alcole in cui il carbonio ha numero di ossidazione -1. Il resto del carbonio con numero di ossidazione +4 viene eliminato come biossido di carbonio.
La fermentazione alcolica perciò è un formidabile agente riducente; in assenza di solfiti l’acetaldeide prodotta per decarbossilazione del piruvato sarà completamente libera e quindi verrà integralmente ridotta ad etanolo per ripristinare il NAD+ sacrificato per ossidare la 3-fosfo-gliceraldeide a 1,3-di-fosfo-glicerato. La priorità del lievito durante la fermentazione alcolica è di mantenere costante il rapporto tra la forma ridotta e la forma ossidata del NAD all’interno del citoplasma.
Quando gli zuccheri saranno completamente consumati il vino torbido verrà nuovamente refrigerato a 2°C per almeno 10 giorni; l’autolisi del lievito deve essere bloccata per circa un mese, dopodiché il vino può essere posto in affinamento alla temperatura di 10°C. E’ a questo punto che i solfiti possono essere aggiunti, in quanto un tenore di 50 mg/L di SO2 (con 30 mg/L di SO2 libera) inibirà lo sviluppo di Lactobacillus brevis, la specie eterofermentativa che è il principale rischio microbiologico, in quanto oltre a consumare l’acido L-(-)-malico produce acetato partendo da molecole quali il glucosio, i pentosi e il citrato, nonché ammine biogene a partire dai composti azotati.
Durante la conservazione del vino il tenore della SO2 libera non deve essere inferiore ai 30 mg/L mentre la SO2 totale è bene non sia mai inferiore ai 50 mg/L; a questo punto sarà possibile contenere il tenore di solfiti in bottiglia senza rinunciare a una buona longevità del prodotto.
RUOLO DEGLI α-AMMINOACIDI E DEL COENZIMA A NELLA BIOSINTESI DEGLI ESTERI
IL TENORE DEGLI α-AMMINOACIDI NEL MOSTO
Nell’uva sono presenti diversi α-amminoacidi che possono essere metabolizzati dal lievito durante la fermentazione alcolica. La quantità di questi amminoacidi è variabile tra 0,5 g/L di mosto (tenore molto basso) e 3 g/L (tenore molto alto) e può essere stimata partendo dal dato analitico dell’azoto α-amminico o PAN (primary amino nitrogen). Questa analisi enzimatica, comunemente svolta nelle cantine, quantifica l’azoto presente nel gruppo α-amminico dell’amminoacido. Nella figura sottostante è mostrato un α-amminoacido su cui sono evidenziate la componente α-amminica (cerchio rosso) e l’azoto α-amminico (cerchio blu).
Dato che il peso atomico dell’azoto (N) è di 14 dalton (Da) mentre il peso molecolare di un α-amminoacido è maggiore possiamo, utilizzare un “fattore di moltiplicazione” per ricavare il tenore di un dato α-amminoacido partendo dal dato analitico dell’azoto in esso presente . Il fattore di moltiplicazione si ricava dalla seguente formula:
fattore di moltiplicazione = Peso molecolare dell’α-amminoacido/Peso atomico dell’azoto α-amminico
La glicina che ha un peso molecolare di 75 Da darà il seguente fattore di moltiplicazione:
FATTORE DI MOLTIPLICAZIONE per glicina = 75 Da/14 Da = 5,3
L’alanina che ha un peso molecolare di 89 Da darà un fattore di moltiplicazione maggiore.
FATTORE DI MOLTIPLICAZIONE per alanina = 89 Da/14 Da = 6,4
La leucina che ha un peso molecolare di 131 Da darà un fattore di moltiplicazione ancora maggiore.
FATTORE DI MOLTIPLICAZIONE per leucina = 131 Da/14 Da = 9,4
Considerando le dimensioni dei diversi α-amminoacidi e le percentuali dei diversi α-amminoacidi tra mosto e mosto è possibile operare una stima degli α-amminoacidi totali partendo dal dato dell’azoto α-amminico.
Dato un tenore di azoto α-amminico pari a 100 mg/L di mosto, potremo stimare un tenore in α-amminoacidi tra 800 e 1000 mg/L ipotizzando un fattore di moltiplicazione compreso tra 8 e 10.
In un mosto dotato di 150 mg/L di azoto α-amminico avremo tra 1200 e 1500 mg/L di α-amminoacidi ipotizzando un fattore di moltiplicazione tra 8 e 10.
In alcuni mosti ricchissimi in APA i livelli di azoto α-amminico possono raggiungere 300 mg/L dunque la concentrazione in α-amminoacidi sfiorerà i 3 g/L.
La disponibilità di α-amminoacidi nel mosto influenza in modo deciso il decorso della fermentazione alcolica. Gli α-amminoacidi sono la più importante fonte di azoto per il lievito e vengono utilizzati nella fase di crescita esponenziale della popolazione, quando essa sale rapidamente da 1.000.000 a 100.000.000 di cellule/mL di mosto. Il lievito può condensare gli α-amminoacidi costituendo macromolecole quali oligopeptidi (fino a 50 unità), polipeptidi (fino a 100 unità) e infine proteine (oltre 100 unità).
Altre volte il lievito sottrae il gruppo α-amminico di un certo amminoacido attraverso la VIA DI EHRLICH per poi utilizzarlo per sintetizzare molecole quali: nuovi α-amminoacidi, basi azotate (con cui vengono prodotti i nucleotidi e quindi gli acidi nucleici), diversi cofattori e vitamine.
MECCANISMO DI AZIONE DELLA VIA DI EHRLICH.
La figura sottostante mostra, in maniera piuttosto semplificata, la VIA DI EHRLICH, dividendola in due step.
Nel primo step l’α-amminoacido viene de-amminato (tramite la trasformazione dell’α-chetoglutarato in glutammato) ottenendo un chetoacido.
Nel secondo step il chetoacido viene decarbossilato con eliminazione di una molecola di CO2 e successivamente ridotto da aldeide ad alcole tramite l’ossidazione del coenzima NADH,H+ a NAD+.
AMMINOACIDI E LORO CORRISPONDENTI ALCOLI.
Attraverso la VIA DI EHRLICH la L-valina origina l’alcol isopropilico, la L-leucina l’alcol isoamilico e la L-isoleucina l’alcol amilico; la 2-fenilalanina produce l’alcol 2-feniletilico, la L-tirosina il tirosolo, l’L-triptofano origina il triptofolo e la L-metionina il metionolo.
FORMAZIONE DEGLI ESTERI A PARTIRE DAGLI ALCOLI: ADDIZIONE TRAMITE IL “COENZIMA A” AGLI ACIDI GRASSI
Gli alcoli formati tramite la VIA DI EHRLICH sono detti “alcoli superiori”, per marcarne la differenza con l’alcol etilico la cui struttura è più semplice.
Tali alcoli superiori vengono espulsi dalla cellula tal quali o nella forma “esterificata”. Gli esteri si formano tramite l’unione di un alcole con un acido carbossilico (acido grasso a corta e media catena): questa addizione necessita che l’acido carbossilico sia attivato da un apposito coenzima, il “Coenzima A”, la cui struttura è mostrata nella figura sottostante.
La struttra del Coenzima A è divisibile in 3 distinti gruppi:
• Adenosin-trifosfato ovvero un nucleoside a cui sono legati 3 gruppi fosfato
• Acido Pantotenico (Vit. B5)
• β-mercapto-etilamina che contiene il gruppo funzionale -SH.
Il Coenzima A è un tiolo e il suo gruppo funzionale –SH ne permette la reattività con gli acidi grassi a corta e media catena presenti nel mosto.
L’azione del Coenzima A nel processo di formazione di un estere è la seguente:
Lo zolfo del gruppo funzionale –SH è elettronegativo e si presta perciò all’addizione nucleofila al carbonio elettropositivo del gruppo funzionale carbossilico: tale addizione è raffigurata da una freccia rossa nella figura.
Il Coenzima A legato all’acile (acil-coenzima A) viene interessato dall’addizione nucelofila dell’ossigeno elettronegativo dell’alcole superiore al carbonio elettropositivo dell’acil-Coenzima A.
Il Coezima A risulta una molecola di grande interesse tecnico e diviene dunque prioritario conoscerne i tenori presenti nel mosto e durante le varie fasi della fermentazione alcolica. Ad oggi questo composto è poco citato nella letteratura enologica, mentre, grazie alla sua ubiquità esso è molto conosciuto nelle scienze biologiche nonché in medicina. Come sempre l’enologia si conferma una disciplina dilettantesca che è costretta ad attingere alle vere scienze. Il mio augurio è che in un futuro non molto lontano venga presa in considerazione la quantificazione di questa molecola nelle principali matrici enologiche: le uve, i mosti, i lieviti, i batteri e i loro derivati ad uso enologico.
ADDIZIONI NUCLEOFILE DEI TIOLI AL CARBONIO FUNZIONALE DELLE ALDEIDI
ADDIZIONI NUCLEOFILE DEI TIOLI AL CARBONIO FUNZIONALE DELLE ALDEIDI
I tioli possono creare degli addotti con le aldeidi sia nel mosto che nel vino, così come in molteplici matrici liquidi in natura. Alcune di queste addizioni cosiddette nucleofile sono propedeutiche alla qualità altre invece possono nuocere alla conservazione degli aromi.
Le aldeidi sono composti organici molto comuni nel mondo vegetale. Ne abbiamo esperienza quotidiana in quanto il loro odore pungente è facilmente percepibile in molte situazioni: l’odore di un prato in cui l’erba sia stata appena tagliata oppure l’odore della buccia di una mela.
Anche nella pratica enologica queste aldeidi sono percepibili in svariate occasioni: ad esempio quando ci si trova nei pressi di una pigiatrice e un odore penetrante proviene dalle bucce dell’uva schiacciata, specialmente con alte temperature. Anche quando apriamo una bottiglia di vino piuttosto in là con gli anni percepiremo un gusto che molti chiamano etereo o svanito, il cui principale responsabile è una aldeide. Infine, se abbiamo consumato molto alcol in una serata ci ricorderemo il tipico sapore al palato che accompagna il mal di testa il giorno dopo: anche questa spiacevole sensazione è causata da una aldeide. Tale aldeide (etanale) è peraltro responsabile del nostro feroce mal di testa (hungover).
Non stigmatizziamo i solfiti per il nostro mal di testa! E’ possibile procurarsi un ottimo mal di testa con birra o vodka, bevande 100% sulphite-free!
La verità è che se assumiamo qualsiasi drink l’alcol etilico una volta in circolo verrà deidrogenato per via enzimatica nel fegato e produrrà l’etanale, che è appunto una aldeide e come tutte le aldeidi è tossica.
Se avremo bevuto responsabilmente (< 20 g alcol per gli uomini adulti, 10 g alcol per le donne e gli anziani) tale aldeide verrà trasformata in acido acetico che non è dannoso per la salute poiché è un normale acido grasso a corta catena che viene degradato nel ciclo di Krebs. Nella figura sottostante è rappresentato il processo metabolico che detossifica l’alcol, reazione catalizzata da due enzimi presenti nel fegato: l’alcol deidrogenasi (ADH1B) e l’aldeide deidrogenasi (ALDH2).
Se invece avremo introdotto oltre 100 g di alcol in una occasione, (binge drinking), il nostro corpo ci presenterà il conto, dopo alcune ore, con un tenace, tagliente mal di testa determinato dagli alti tenori di acetaldeide raggiunti nell’organismo; questa permanenza dell’acetaldeide dura svariate ore, fino a che l’enzima ALDH2 (aldeide deidrogenasi) non riuscirà ad ossidare tutta l’acetaldeide nella innocua molecola dell’acido acetico. Che l’alcol provenga dalla birra più economica o dal miglior cognac, da un vino con zero solfiti biodinamico e imbottigliato a mano o da un comune vino contenente solfiti, il mal di testa lo avremo ad ogni modo. Questo dice la scienza.
LA TOSSICITA’ DELLE ALDEIDI E’ DATA DALLA LORO REATTIVITA’
L’etanolo è certamente nocivo, ma è l’etanale ad essere tossica.
Tutti sappiamo che il metanolo può rendere ciechi, ma non tutti forse sanno che è la forma più ossidata del metanolo, ovvero l’acido metanoico (o formico) a distruggere le proteine della retina e, a dosi più elevate, a distruggere il sistema nervoso centrale provocando la morte. L’intermedio di reazione, altrettanto tossico, è il metanale (formaldeide).
Le aldeidi possono danneggiare le membrane cellulari del nostro organismo: l’acetaldeide in particolare può creare degli addotti con gli acidi nucleici, il che la rende cancerogena.
L’acetaldeide opera una immediata e forte vasodilatazione dei dotti sanguigni determinando un arrossamento della pelle. Ma quale è il motivo di questa tossicità?
COMPORTAMENTO ELETTROFILO DEL CARBONIO FUNZIONALE
La tossicità delle aldeidi sta nella particole reattività del gruppo funzionale come mostrato in figura sottostante. Il carbonio del gruppo funzionale è legato a un ossigeno e a un idrogeno: l’ossigeno è un atomo fortemente elettronegativo, che sottrae carica elettrica al carbonio funzionale, rendendolo parzialmente elettropositivo. Questa parziale carica positiva sul carbonio funzionale lo rende un atomo “elettrofilo”, ovvero un atomo che in funzione della sua parziale carica positiva attira molecole con caratteristiche elettronegative, determinando una addizione nucleofila come esemplificato nella figura sottostante.
MOLECOLE SOLFORATE CHE POSSONO REAGIRE CON LE ALDEIDI
I tioli sono nucleofili in quanto portatori di una parziale carica negativa sullo zolfo del gruppo funzionale.
Osserviamo il comportamento del più semplice dei tioli: l’idrogeno solforato. L’idrogeno solforato, H-S-H, presenta una elettronegatività sullo zolfo; lo zolfo è perciò nucleofilo dunque attratto dal carbonio carbonilico elettropositivo (elettrofilo). Il composto che deriva dalla sostituzione dell’ossigeno con lo zolfo è una tioaldeide.
Le aldeidi e i tioli hanno in generale una affinità che li porta a legarsi creando composti detti EMITIOACETALI.
Questo comportamento può essere sfruttato nel caso della modulazione degli aromi prefermentativi. D’altro canto, durante la conservazione del vino, tale processo porta alla perdita dei tioli formati in fermentazione.
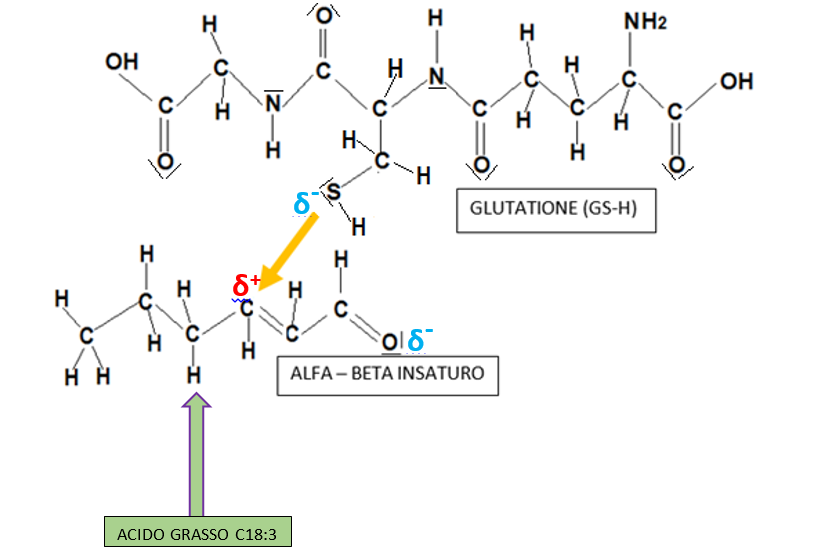
Riassumendo possiamo dire che le interazioni tra le aldeidi alfa – beta insature derivanti dagli acidi grassi C18:3 presenti nelle membrane cellulari delle cellule vegetali hanno una sinergia con i tioli dell’uva, in particolar modo il glutatione (GLY-CYS-GLU), per una addizione nucleofila rappresentata dalla freccia gialla.
L’addotto che si forma è un precursore del 3-mercapto-esan-1-olo, che si libera successivemente per via fermentativa con una resa piuttosta bassa, all’incirca, l’1%.
L’etanale presente nel mezzo potrebbe fare da attrattore per la parziale carica elettrica negativa sull’ossigeno al C1 del 3-mercapto-esan-1-olo, dando origine al corrispondente addotto emiacetalico (1-((3-mercaptoesil)osso)etan-1-olo.
La reattività tra aldeidi e tioli è un tema che si presta ad ipotesi, essendo il loro rapporto piuttosto controverso. Personalmente auspico una sperimentazione in merito, essendo lo stato dell’arte ancora ricco di interrogativi.
CORRELAZIONE TRA STRESS IDRICI E METANTIOLO NEL VINO
L’incremento delle temperature e i ricorrenti stress idrici nelle ultime due decadi hanno fortemente diminuito la dotazione in azoto α-amminico nelle uve e quindi nei mosti. Ciò induce il lievito a ricercare fonti azotate nell’amminoacido metionina, producendo metantiolo, una molecola dall’odore agliaceo. Per evitare la formazione del metantiolo è necessario fornire ammonio sui mosti poveri in azoto α-amminico sin dalle prime fasi della fermentazione; i derivati di lievito ad uso enologico non riescono, ai comuni dosaggi (20 – 40 g/hL) a supplire la carenza in azoto α-amminico se questo è al di sotto dei 50 mg/L nel mosto di partenza.
Negli ultimi 20 anni le temperature medie sono aumentate e gli anticicloni di matrice africana hanno dominato le estati in tutto il bacino del Mediterraneo, ovvero in tutte le aree a tradizione viticola.
Si sono raggiunti picchi termici di 42 – 43°C non solo in aree tradizionalmente calde come la Spagna, il Sud Italia e il Midi Francese, ma anche in Nord Italia, nel Bordolese, in Borgogna, nella Valle del Reno.
Contestualmente le precipitazioni sono crollate nel periodo estivo in tutto il Continente Europeo. Non vi è alcuna area d’Europa, al di sotto del 50° parallelo che non abbia sperimentato estati roventi. Il serbatoio di tali ondate di caldo che sono arrivate a toccare più volte persino la Lapponia si trova nel deserto algerino. In tale area, a soli 1000 km in linea d’aria dalla coste dell’Italia si raggiungono temperature di 50°C. Negli anni queste potentissime bolle di aria rovente si trasferiscono sul Mare Mediterraneo, che essendo un bacino chiuso si scalda fino a raggiungere in Agosto, temperature superficiali di 30°C.
Il riscaldamento del Mediterraneo determina un incremento delle temperature notturne, che è di particolare importanza per la vegetazione. Infatti, alte temperature notturne determinano nelle cellule delle foglie una maggiore respirazione, catabolizzando l’acido malico e determinando una diminuzione degli amminoacidi. Questo fenomeno si estende ovviamente anche alle bacche d’uva, per cui i mosti risultano poveri in azoto amminoacidico; questa forma di azoto è l’azoto α-amminico: “α”, in quanto il gruppo funzionale amminico è posto sul carbonio “α”, ovvero il carbonio prossimale al carbonio carbossilico (figura sottostante).
GLI AMMINOACIDI PRESENTI NEL MOSTO VENGONO RICOMBINATI DAL LIEVITO
Gli amminoacidi presenti nel mosto vengono assorbiti dal lievito e riarrangiati in modo da produrre le proteine e i peptidi che al lievito sono necessari. Ciò avviene nella fase di crescita esponenziale del lievito, ovvero quando la popolazione, espressa in cellule/mL, cresce in pochi giorni da 100.000 a 100.000.000 di cellule/mL.
La cellula del lievito smonta gli amminoacidi eliminando i gruppi amminici o parti dello scheletro alchilico (R); infine gli amminoacidi possono essere privati del carbossile dando origine agli alcoli superiori (tema che merita approfondimento in altra sede).
LA DEAMMINAZIONE DEGLI α-AMMINOACIDI DA PARTE DEL LIEVITO
La deamminazione avviene sul carbonio α dell’amminoacido, sostituendo l’idrogeno e il gruppo –NH2 (cerchiati in blu nella figura sottostante) e ponendo su tali valenze rimaste libere un atomo di ossigeno che verrà legato al carbonio α tramite una doppia valenza.
Il coenzima NAD+ sottrae un idrogeno dal carbonio α dell’amminoacido creando un radicale elettropositivo su cui si innesta l’ossigeno donato da una molecola d’acqua; sul carbonio α si crea perciò un gruppo chetonico, che rende il chetoacido chimicamente stabile, in quanto portatore di due doppi legami coniugati (cerchiati in verde nella figura).
In questo modo il lievito ha ricavato una molecola di ammonio, mattone essenziale al fine di sintetizzare nuovi amminoacidi ad esso necessari. In caso di mosti carenti di azoto il lievito deve operare una trasformazione su tutti gli amminoacidi presenti nel mosto; questo comporta pure l’attacco di alcuni amminoacidi solforati, tra cui il più pericoloso per il bouquet del vino è la metionina.
LA METIONINA E’ UN PRECURSORE DEL METANTIOLO
La metionina è un α-amminoacido solforato, in quanto contiene un atomo di zolfo: secondo la reazione spiegata nel paragrafo precedente la metionina può essere decomposta dal lievito in 3 molecole:
1. il chetoacido, che in questo caso è l’acido α-cheto-butirrico
2. lo ione ammonio, che è la forma solubile dell’ammoniaca al pH acido del mosto – vino
3. il metantiolo, che è la “coda” dello scheletro carbonioso (R)
Il metantiolo è una molecola estremamente odorosa e purtroppo il suo descrittore è l’aglio: una volta che si è liberato nel vino è impossibile eliminarlo senza compromettere i tioli gradevoli, come il 3MH e il 4MMP.
Se in un mosto osserviamo la lisi di un solo mg/L di metionina avremo la liberazione di 330 μg/L di metantiolo: siccome la soglia di percezione del metantiolo è di 20 μg/L, la decomposizione di 1 mg/L di metionina determina una concentrazione di metantiolo pari a oltre 16 volte la sua soglia di percezione: in altri termini il metantiolo, originando un odore tra l’aglio e il cavolo cotto, coprirà completamente le note fruttate del vino, anche se marginali tenori di metionina verranno decomposti.
COME EVITARE LA FORMAZIONE DI METANTIOLO
Il metantiolo come tutti i solfuri, se messo a contatto con l’ossigeno può creare il dimetildisolfuro (DMDS); per questo motivo i vini con odore di aglio vengono, da taluni, arieggiati o macro-ossigenati.
2 CH3-SH + ½ O2 -----> CH3-S-S-CH3 + H20
DMDS
Purtroppo il DMDS è caratterizzato da un forte odore di aglio, quindi la sua formazione via ossigenazione non risolve il problema. La sola via per evitare questi “off-flavours” è la prevenzione, ovvero offrire al lievito una alternativa all’attacco della metionina nei mosti a scarsa dotazione azotata.
Se i mosti che andremo a fermentare sono molto poveri in azoto α amminico e in azoto ammoniacale possiamo attenderci che il lievito attaccherà la metionina: a tal proposito potrebbe essere utile analizzare il tenore in metionina nel mosto. Ma data la bassissima soglia di percezione del metantiolo nemmeno un basso tenore di metionina costituirebbe una totale garanzia.
Il lievito scompone la metionina per ottenere lo ione ammonio e l’acido α-cheto-butirrico; l’ammonio gli è necessario per formare nuovi amminoacidi mentre l’acido α-cheto-butirrico entra nella via di sintesi dell’isoleucina, un altro amminoacido utile al lievito.
Il metantiolo invece al lievito non serve e viene liberato nel mezzo.
Fornire ammonio è la via più facile in caso di estreme carenze in azoto α-amminico. Un mosto con 50 mg/L di azoto α-amminico può essere fornito di 60 mg/L di ammonio (300 mg/L di DAP). L’unica attenzione va fatta nel trovare il momento ideale in cui fornire l’ammonio: tale aggiunta va fatta in concomitanza con la fase di crescita esponenziale, quando il lievito deve creare nuove cellule (in questo momento l’ammonio naturale è di certo già scomparso dal mezzo, cosa facilmente verificabile con una analisi enzimatica).
Oltre a fornire ammonio possiamo fornire estratti di lievito ad uso enologico, che sono più o meno ricchi in amminoacidi. Incrementare l’azoto α-amminico tramite l’aggiunta di derivati di lievito è impresa ardua e costosa. Ad esempio per portare l’α-amminico di un mosto da 50 mg/L a 100 mg/L servono non meno di 100 g/hL di derivati di lievito e spesso assai di più. Tali dosaggi non sono contemplati nella comune pratica enologica, dove le aggiunte si aggirano attorno ai 20 – 40 g/hL. Con tali aggiunte l’incremento in azoto α-amminico sarà pari a 10 – 20 mg/L, non sufficiente a scongiurare la formazione di metantiolo.
Si può tranquillamente affermare che un clima mite e piovoso sarebbe il miglior attivante, in quanto fino al 2000, quando le estati erano mediamente più fresche e piovose, le dotazioni in azoto α-amminico erano spesso anche eccessive (200 mg/L di mosto). Ora nelle stesse zone si è passati a 50 mg/L!
Ma sul clima occorre soffermarci in un secondo momento tanto è vasto l’argomento e tante sono le implicazioni che sta avendo, in particolar modo sul regno vegetale.
ACIDO SUCCINICO: CARATTERISTICHE E FORMAZIONE DA PARTE DI SACCHAROMYCES CEREVIASIAE
ACIDO SUCCINICO: CARATTERISTICHE E FORMAZIONE DA PARTE DI SACCHAROMYCES CEREVIASIAE.
L’acidità dell’uva è composta principalmente da due acidi dicarbossilici: l’acido L (+) tartarico e l’acido L (–) malico. Durante la maturazione si assiste ad una diminuzione del tenore di questi due acidi, diminuzione che è proporzionale al calore esterno: è per questo motivo che negli ultimi 20 anni le acidità totali sono via via diminuite. Molte varietà perdono forti tenori di acido malico, che alla raccolta può addirittura arrivare al di sotto di 1 grammo/litro. L’acido tartarico oltre ad essere consumato per via metabolica nell’uva viene ad essere attaccato dal potassio, che lo precipita: i tenori di potassio parimenti sono aumentati nel corso degli anni, arrivando a superare i 2 grammi/litro. In vinificazione è perciò normale assistere ad un ulteriore calo dell’acidità del vino. Tuttavia vi è un acido che non è presente nell’uva e che viene formato durante la fermentazione alcolica ad opera dei lieviti: tale acido è il succinico.
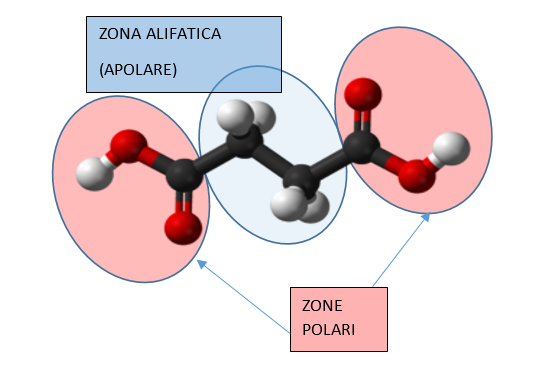
L’acido succinico (da succinum, ambra) è il più debole degli acidi non volatili presenti nel vino, avendo una pka di 4,15, mentre l’acido L (+) tartarico ha una pka pari a 2,89, l’acido L (-) malico di 3,40, il citrico di 3,13 e l’L (+) lattico di 3,86: l’acido succinico è quindi 18 volte meno forte del tartarico, 6 volte meno forte del malico, 10 volte meno forte del citrico e quasi 2 volte meno forte del lattico; la sua scarsa propensione alla dissociazione in acqua rispetto agli altri acidi del vino è dovuta alla natura alifatica dei due carbonii centrali, come si può vedere in figura 1.
L’acido succinico (AS) è l’acido maggiormente prodotto durante la fermentazione del glucosio in etanolo. Analisi fatte nel campo della panificazione evidenziano come da 100 grammi di farina il lievito Saccharomyces cerevisiae produca fino a 2 grammi di acido succinico, determinando un significativo abbassamento del pH dell’impasto, da pH 5,8 a 4,8 (Vinay B. Jayaram, et al.). La tendenza di Saccharomyces cerevisiae ad acidificare i mezzi zuccherini tramite la fermentazione alcolica si svela in modo peculiare in svariati campi delle biotecnologie: sebbene il lievito S.c. non possa essere definito acidofilo, in quanto sviluppa a pH ottimali tra 4 e 5, è stato ampiamente dimostrato come esso svolge la propria attività sino a pH 2,5 come si vede nella figura sottostante.
La tendenza del lievito a produrre AS è stata riconosciuta anche nella trasformazione da mosto a vino. L’AS partecipa in modo sostanziale all’acidità fissa del vino e, dato che il suo peso molecolare è pari al 78% di quello dell’acido tartarico, sovente l’incremento in acidità totale dovuto all’acido succinico è di oltre 1 punto, ovvero dal 15 al 20% della somma degli acidi. L’AS approssimativamente ammonta al 90% dell’acidità prodotta dal lievito, mentre il restante 10% è dato dall’acido D (-) lattico.
Nei vini bianchi l’AS è presente da 0,1 fino a 1,6 g/L con valore medio pari a 0,6 g/L, mentre nei vini rossi è presente in tenore doppio, mediamente 1,2 g/L con picchi di 2,6 g/L (3,3 g/L di acidità totale) Si può dunque affermare che nei vini bianchi l’acido succinico è il terzo acido in ordine di presenza, mentre nei vini rossi può addirittura essere il secondo, specialmente nei vini che derivano da uve povere in acido malico (fenomeno sempre più frequente a causa del clima torrido).
Per apprezzare davvero l’incremento dell’acidità in un mezzo fermentato è necessario sottrarre l’influenza del potassio. Nel mosto la presenza di tenori di potassio superiori a 1,5 g/L determina una forte salificazione dell’acido tartarico che origina il sale acido “bitartrato di potassio”; tale sale precipita, eliminando dal mezzo oltre di 2 g/L di acidità totale. Perciò la formazione di acido succinico viene mascherata dalla diminuzione di acidità totale.
Nel caso in cui Saccharomyces cerevisiae fermenti un mezzo privo di acidi, ovvero una soluzione idrozuccherina, si riscontra un abbassamento del pH dalla neutralità verso un valore inferiore a 3 (prove sperimentali su svariati ceppi). La produzione di 1,6 g/L di acido succinico in un mezzo acquoso porta il pH da 7 a 2,95; alcuni lieviti lavorando su un mezzo acquoso possono portare il pH sino a 2,60, con una produzione di 10 g/L di acido succinico.
La tendenza del lievito a produrre questo acido in grosse quantità in presenza di pH di partenza elevati può essere interpretata come un tentativo dello stesso di abbassare il pH sino a condizioni tali da porsi in un campo di sicurezza rispetto alla competizione con altri microorganismi non acidofili (intendiamo come acidofilo un microorganismo che sviluppa a pH inferiore a 3). Nelle uve povere in acido L (+) tartarico e ricche in potassio questo sforzo è vanificato dall’etanolo che insolubilizza il bitartrato di potassio e in misura minore il tartrato di calcio.
Molto spazio è stato dato alla (più o meno presunta) produzione di acido malico da parte di alcuni ceppi di Saccharomyces cerevisiae o bayanus, ma questa produzione è di peso assai minore rispetto alla produzione di acido succinico. Se vi fosse una forte produzione di acido malico da parte del lievito, i vini al termine della fermentazione dovrebbero presentare un tenore significativo di questo acido, mentre invece sempre più spesso si osservano tenori in acido L (-) malico inferiori a 1 g/L sia nei vini bianchi che nei vini rossi (Pinot Grigio e Merlot in primis). Nello specifico è facile capire quale sia la produzione microbiologica dell’acido malico e dell’acido succinico monitorando questi due acidi con analisi enzimatiche o cromatografiche: verrà quindi facilmente dimostrato come in qualsiasi fermentazione alcolica la produzione di acido malico è di gran lunga minore rispetto alla produzione di acido succinico. È stato invece ampiamente dimostrato come i l’acido L (-) malico possa anzi essere consumato dal lievito, via ciclo di Krebs. L’importanza dell’AS nell’incremento dell’acidità fissa del vino durante la fermentazione alcolica è stata ormai confermata dagli enologi di tutto il mondo, e in special modo nel Nuovo Mondo, in Australia, Sud Africa, California.
L’acido succinico non è un acido fresco e tagliente come il malico, ma è piuttosto salino e amarognolo e dà un notevole contributo alla pienezza del vino e alla sua persistenza al palato.
Il suo estere, il dietil succinato, è particolarmente presente nel Cabernet Sauvignon e nel Tinta Nigra sino a oltre 1 grammo/litro, ma con un valore medio di 200 mg/L conferendo un carattere fruttato, tendente verso la mela dolce e il melone. L’etil succinato è un altro estere di questo acido e conferisce note fruttate; anche questo estere può essere presente in quantitativi prossimi al grammo.
La formazione di acido succinico si origina dagli zuccheri e dagli amminoacidi. Oltre che dalla varietà dell’uva il tenore in acido succinico nel vino finale dipende dai seguenti fattori.
· Ceppo di lievito (interessante spunto di indagine su cui però al momento c’è poco materiale)
· Temperatura di fermentazione: massima produzione a 30°C
· pH: massima produzione a pH alti (4)
· aereazione: l’aereazione favorisce il ciclo di krebs, e quindi la formazione di acido succinico
· presenza di azoto: è correlata positivamente, e in special modo la presenza di aspartato e glutammato
· presenza tiamina (B1), biotina (B7) e acido pantotenico (B5)
· grado zuccherino
· presenza di solidi sospesi
· fermentazione in legno
CONCLUSIONI
L’acido succinico è l’acido maggiormente prodotto dal lievito; può quindi essere interessante capire quali ceppi siano i maggiori produttori. Non può essere purtroppo essere considerato come un sostituto dell’acido malico, in quanto la sua forza di dissociazione acida è minore. Può essere però considerato un acido molto importante per i vini che svolgano la malolattica in presenza di scarsi tenori di acido L (-) malico, e che danno conseguentemente scarsi tenori di acido L (+) lattico (inferiori a 1 g/L). Probabilmente il suo ruolo principale può essere giocato nella produzione di vini (sia bianchi che rossi) da uve molto mature, con gradazioni alcoliche superiori ai 14%, nei quali può aiutare ad evitare la piattezza dovuta ad acidità necessariamente basse (specialmente la parte malica). L’induzione di una sua maggiore produzione, può essere svolta modulando la disponibilità di azoto, vitamine e torbidità, in attesa di capire quali ceppi ne siano i maggiori produttori.
STECHIOMETRIA DELLA TRASFORMAZIONE DEL GLUCOSIO
Il glucosio e il fruttosio sono i principali zuccheri presenti nel mosto. Il loro peso molecolare è equivalente, infatti possiamo definirle questi due composti come isomeri (molecole con stessa composizione in atomi ma differente disposizione degli atomi nella molecola).
Il glucosio rappresenta la fonte energetica per lo sviluppo di innumerevoli forme di vita, dai microorganismi unicellulari sino ai mammiferi: è il substrato energetico per eccellenza e la sua combustione necessita di tre passaggi, di cui il primo, universale in biologia, è la glicolisi (lisi del glucosio); tale reazione comprende anche il fruttosio. Nell’immagine sottostante la formula di struttura del D-glucosio.
Sia il glucosio che il fruttosio hanno formula bruta C6H1206 , il loro peso molecolare è 180 dalton, perciò una mole di G o F pesa 180 g.
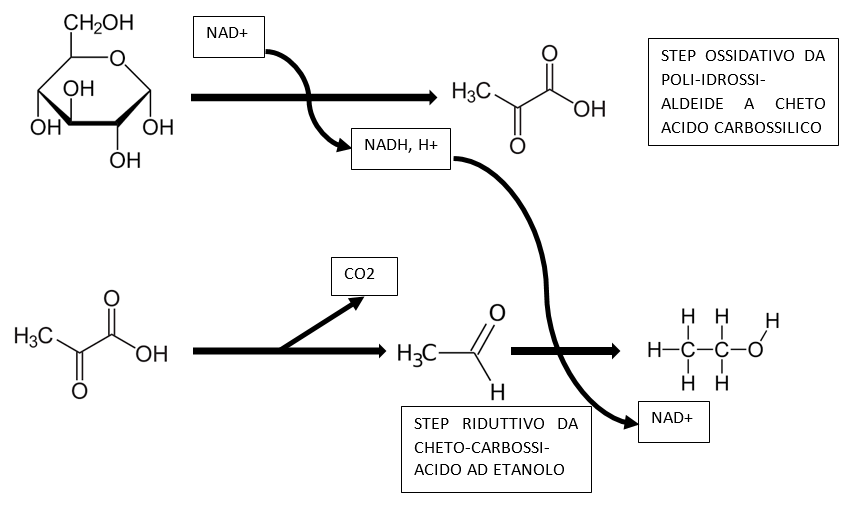
La glicolisi trasforma il glucosio e il fruttosio (G + F) in acido piruvico, con una reazione ossidativa (aldeide -> acido carbossilico), determinando la riduzione del coenzima NAD+ a NADH,H+.
Il successivo utilizzo dell’acido piruvico differisce tra i microorganismi dotati di mitocondri e i microorganismi in cui i mitocondri sono assenti oppure non attivi (è questo il caso di Saccharomyces cerevisiae nel mosto); in questo secondo caso l’acido piruvico non aziona il ciclo di Krebs, via acetil-CoA, e dunque non vi è una ulteriore produzione di NADH,H+. Solo se sviluppato in un mezzo molto povero in glucosio (< 9 g/L) e abbondante ossigenazione il lievito attiva i mitocondri. Nel mosto, in cui il glucosio e il fruttosio sommati sono superiori ai 180 g/L è impossibile, a prescindere dalla quantità di ossigeno fornita, che il lievito possieda mitocondri attivi; di conseguenza il NADH,H+ che si forma nella ossidazione del glucosio (una poli-idrossi-aldeide) ad acido piruvico (un cheto-acido carbossilico), deve essere riossidato a NAD+ per riduzione dell’etanale ad etanolo, come mostrato nella figura sottostante.
La riduzione dell’acetaldeide (etanale) ad etanolo è necessaria al lievito per ripristinare il NAD+ necessario allo svolgersi della glicolisi; per il lievito l’unico modo per ottenere energia è la glicolisi, che per ogni mole di glucosio ossidata produce 2 moli di ATP. Ecco perché l’acido piruvico viene decarbossilato, con produzione di CO2, ad acetaldeide, che può quindi essere ridotta ad alcol etilico (etanolo).
Sulla base della stechiometria di questa reazione possiamo calcolare la resa fermentativa da glucosio ad alcol etilico.
Un mezzo contenente una mole di glucosio (180 g/L) produce per via fermentativa due moli di etanolo (92 g/L)
La resa in alcol espressa in peso perciò è:
92 g / 180 g = 51%
Dato che l’alcol etilico, per convenzione, è espresso in volume su volume il suo peso va trasformato in volume, dividendolo per la sua massa volumica a 20°C, ovvero 0,789 g/mL.
92 g /(0,789 g/mL) = 92/0,789 mL = 116,6 mL
Da cui si ha la resa da glucosio in peso ad alcol etilico in volume:
116,6 mL / 180 g = 65%
Un mosto con un tenore di G+F pari a 200 g/L dovrebbe produrre un vino con 130 mL/L di alcol etilico. Ma da G+F il lievito produce una lunga serie di metaboliti secondari, di cui il glicerolo è il più importante: il glicerolo può variare da un minimo di 2 g/L (in questo caso modificando di poco la resa teorica del 65% in P/V) sino a un massimo di 12 g/L (con forte abbattimento della resa in alcol, come poi vedremo).
MUTAZIONE DEI PARAMETRI FISICI durante la trasformazione del glucosio in alcol
Esaminiamo una soluzione contenente acqua deionizzata e 200 g/L di glucosio e fruttosio (G+F); rispetto all’acqua i due solventi hanno un peso specifico nettamente superiore:
Peso specifico del glucosio = 1,56 g/mL
Peso specifico del fruttosio = 1,69 g/mL
Considerando una media tra i due abbiamo un valore di 1,625 g/mL
Il volume occupato dal soluto, (G+F) è dunque pari a:
200 g/1,625 g/mL = 123 mL (cm3)
Il volume occupato dal solvente (l’acqua) è:
1000 mL – 123 mL = 877 mL
Con la fermentazione alcolica gli 877 mL di acqua non vengono coinvolti mentre i 123 mL (200 g) di G+F si trasformano in 130 mL di alcol etilico.
Con la fermentazione alcolica si ha dunque una forte perdita di peso, dato che un composto ad alto peso specifico (G + F) viene trasformato in un composto a basso peso specifico (etanolo). Ma ora vedremo come a questa perdita di peso non corrisponda una perdita di volume.
CALCOLO DELLA VARIAZIONE DI VOLUME IN UNA FERMENTAZIONE DI UN MEZZO CON 200 g/L DI G+F
Volume G+F = 200 g/1,625 g/mL = 123 mL
200 g di G+F producono 130 mL di alcol etilico
(130 – 123) mL = + 7 mL
In teoria partendo da 1 litro di soluzione a 200 g di G+F si dovrebbero ottenere 1,007 litri di soluzione idroalcolica.
La reazione però non è stechiometrica in quanto circa 7 g di glicerolo sono prodotti al posto dell’alcol. La quantità di alcol etilico prodotta realmente sarà dunque:
(102 – 7) g = 95 g di alcol etilico effettivamente prodotti
Possiamo affermare, pur con un certo margine di errore:
Volume G+F = 123 mL
Volume alcol effettivo = 95 g/ (0,789 g/mL) = 120 mL di alcol etilico
a cui vanno sommati:
7 g/(1,26 g/mL) = 5,5 mL glicerolo
Il volume finale del fermentato sarà dunque la somma dei volumi di acqua, alcol etilico e glicerolo; dunque:
1000 mL (soluzione zuccherina a 200 g/L) – 123 mL (G+F) = 877 mL (acqua)
877 mL (acqua) + 120 mL (alcol etilico) + 5,5 mL (glicerolo) = 1002 mL
Possiamo affermare che la variazione di volume per fermentazione di G+F sia perciò trascurabile. Ovviamente in biologia le regole matematiche non sono applicabili al cento per cento. La resa in glicerolo può essere più bassa o più alta. Se la resa è più bassa di 7 g/L allora si avranno più grammi di alcol e perciò un maggiore volume alcolico. finale.
Un ceppo con una fermentazione molto pura darà da 200 g/L di G+F un tenore alcolico prossimo a 13%; un ceppo con una fermentazione molto ricca in sottoprodotti darà un tenore alcolico prossimo a 12%; nel caso (peraltro raro) vi fosse una produzione da parte del lievito di 12 g/L di glicerolo avremmo:
12 g/(1,26 g/mL) = 9,5 mL glicerolo
(102 – 12) g = 90 g di alcol etilico effettivamente prodotti
90 g/(0,789 g/mL) = 114 mL alcol etilico effettivamente prodotti
Il volume della massa fermentata in questo caso rimarrebbe invariato.
877 mL (acqua) + 114 mL (alcol etilico) + 9,5 mL (glicerolo) = 1000,5 mL
E’ lecito supporre che una fermentazione tumultuosa, possa, tramite il flusso della CO2, ìe a temperatura di 35 - 38°C, trascinare con sé dell’alcol etilico e dell’acqua sotto forma di vapori, sottraendo volume per motivi fisici anzi che chimici. Possiamo comunque affermare con una certa tranquillità che da 1 litro di mosto si otterrà almeno 1 litro di vino, anche con le rese più sfavorevoli.
CALCOLO DELLA PERDITA DI PESO
Se il volume del prodotto rimane invariato è noto invece che con la fermentazione alcolica si ha una perdita di massa e ciò per il semplice fatto che 98 grammi di CO2 abbandonano il mezzo (con 200 g/L di G+F) durante la fermentazione.
Un litro di soluzione acquosa con 200 g/L di G+F ha un peso di:
200 g di G+F + 877 g di acqua = 1077 g/L
Il fermentato che ne deriva ha un peso di:
102 g di etanolo + 877 g di acqua = 979 g/L
Rispetto ad una soluzione idroalcolica il vino è però più complesso. Quindi non avremo 877 g di acqua, ma avremo circa 865 g di acqua e la rimanente parte di estratto. Teoricamente,
(877 – 865) g = 12 g di estratto.
Ma tale espressione matematica presupporrebbe che l’estratto abbia lo stesso peso specifico dell’acqua, mentre il peso specifico dell’estratto è nettamente superiore a quello dell’acqua, anche se non è perfettamente quantificabile, poiché varia da vino a vino. Si può proporre una approssimazione a 1,4 g/mL per cui l’espressione diverrebbe:
(877 – 865) mL = 12 mL (volume occupato dall’estratto in un vino)
12 x 1,4 g = 17 g (peso dell’estratto in un vino fermentato senza bucce)
Il peso di 1 litro di vino può essere calcolato con questa espressione, supponendo che G+F siano completamente consumati:
95 g di etanolo + 7 g glicerolo + 865 g di acqua + 17 g di estratto =
984 g
Un litro di vino bianco, con un estratto molto basso (< 20g/L) peserà dunque un po’ meno di 990 g alla temperatura di 20°C.
Qual è dunque la resa dal G+F?
E’ onestamente difficile dare una risposta. Il coefficiente del 60% che da molti è adottato risulta spesso in una sottostima del grado alcolico effettivo. Il mio consiglio è adottare un coefficiente di 0,625, per lo meno nei mosti atti a dare vini bianchi con tenore alcolico attorno ai 12,5% V/V.
GLI ACIDI GRASSI DEL LIEVITO: STRUTTURA E CARATTERISTICHE
Il lievito enologico per eccellenza, Saccharomyces cerevisiae, come tutti gli organismi unicellulari, delimita il citoplasma dall’ambiente esterno tramite una membrana cellulare; anche il nucleo della cellula è delimitato da una membrana nucleare. La membrana cellulare è posta all’interno della parete cellulare, con cui non va confusa. La parete cellulare è composta da polisaccaridi, tra cui le mannoproteine, ed ha uno scopo di delimitazione con il mezzo in cui il lievito sviluppa, ma è uno scopo principalmente meccanico. La membrana cellulare, invece, ha una funzione fisiologica di primario rilievo. Specialmente la sua integrità è di fondamentale importanza nelle fasi finali della fermentazione alcolica, in quanto l’alcol ha la capacità di assottigliarla fino a farle perdere il 30% del suo spessore.
La membrana cellulare è polare al suo esterno, mentre è apolare al suo interno. I mattoni della membrana cellulare sono i fosfolipidi, molecole complesse che possono essere schematizzate nella seguente immagine.
Nella figura in alto, seppure in modo semplificato, si osserva la componente fosfolipidica della membrana cellulare. In verde sono rappresentati gli acidi grassi; in giallo, la componente non lipidica.
L’acido grasso più lungo, con 18 atomi di carbonio è l’acido stearico, che è un C18:0, in quanto ha 18 atomi di carbonio e 0 insaturazioni. L’assenza di insaturazioni, ovvero di doppi legami tra carbonio e carbonio determina la linearità della molecola.
Un altro acido grasso di rilevante importanza è l’acido palmitico, che è un C16:0, avendo 16 atomi di carbonio e nessuna insaturazione. Come si può vedere dalle formule di struttura gli acidi grassi saturi, ovvero con zero insaturazioni, sono lineari. Gli acidi grassi saturi sono presenti nei derivati animali (es il burro). Gli acidi grassi insaturi sono presenti nei derivati vegetali (olio d’oliva, olio di lino). La regola prevede, come sempre accade in natura, delle eccezioni.
Oltre agli acidi grassi saturi, ovvero lineari, vi sono gli acidi grassi monoinsaturi, che presentano una curva sul punto di insaturazione (ovvero il doppio legame). L’acido oleico ha 18 atomi di carbonio ed una insaturazione sul C9. L’acido palmitoleico ha 16 atomi di carbonio ed una insaturazione sul carbonio 9 (C9).
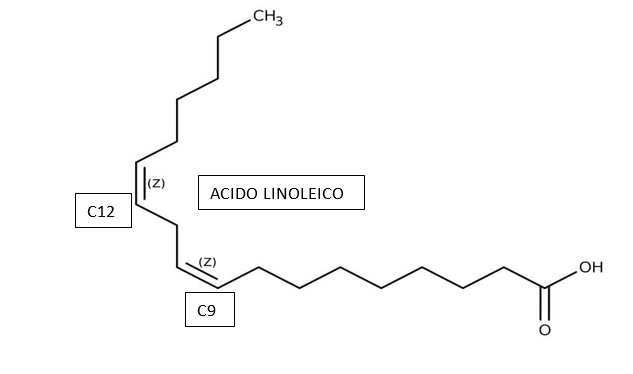
Esiste poi una piccola frazione di acidi grassi a doppia insaturazione, ovvero l’acido linoleico che è un C18:2 con insaturazione su C9 e C12. L’acido linoleico è noto per essere un omega – 6.
Nella membrana cellulare vi sono diversi acidi grassi e un sunto, per quanto indicativo, è riportato nella tabella sottostante. Notiamo che vi sono piccole percentuali di acidi grassi a media catena, di cui parleremo dopo. Il più rappresentato pare essere l’acido palmitico C16:0, seguito dalla forma cis dell’acido oleico C18:1; vi è una piccola percentuale di acido linoleico C18:2.
Come si formano gli acidi grassi nella cellula del lievito? Il precursore è il glucosio, da cui, via glicolisi si forma l’acido piruvico, e per decarbossilazione il radicale acilico che viene legato al coenzima A. Il coenzima A è un trasportatore di radicali acilici. Il radicale acilico è un acido carbossilico privato dell’ossidrile
Dall’unione tra gruppo acetile e il coenzima A si ottiene l’acetil coenzima A. Nell’immagine sottostante è raffigurata la molecola, con il gruppo acetile evidenziato in rosso.
Tramite l’enzima FAT (FATTY ACID SYNTHASE) i mattoni degli acidi grassi vengono saldati tra loro a formare delle catene di 16 o 18 atomi di carbonio, tramite l’azione del coenzima A. Al fine di ottenere acidi grassi a lunga catena (C16, C18) è necessario che il lievito possa innanzitutto spostare i radicali acetilici tramite il coenzima A: è quindi necessario che nel mosto ci sia fosforo, azoto e zolfo, che oltre al carbonio sono i mattoni fondamentali della molecola. Il successivo step nella formazione degli acidi grassi è la carbossilazione dell’acetil coenzima A, da cui si ottiene il malonil coenzima a A: nella figura sottostante l’acile dell’acido malonico è evidenziato in verde.
Cercando di semplificare la reazione possiamo dire che la componente polare selezionata in verde viene addizionata di volta in volta di due etili (previa eliminazione degli ossigeni) che vengono trasportati dal coenzima A sotto la forma di acetili (selezionati in rosso).
Come avviene pure nel corpo umano è con questa via metabolica che una parte del glucosio viene trasformata in acidi grassi e negli animali in trigliceridi che vanno a costituire il tessuto adiposo.
È stato dimostrato che un mezzo ricco in acidi grassi di origine vegetale, (nel nostro caso le bucce dell’uva) principalmente linoleico e linolenico, rende più funzionale le membrana del lievito, migliorandone il metabolismo. In poche parole, un mosto più verde e più torbido, aiuta il lievito a fermentare.
A parità di altri fattori, quali zuccheri, azoto disponibile, pH la fermentazione ad alte NTU permette al lievito migliori performance. Questo fatto è facilmente osservabile in cantina: i mosti con NTU inferiori a 20 peggiorano la funzionalità di membrana del lievito: il lievito utilizza meno l’azoto alfa amminico e tende a produrre più acido acetico, infine, sono più probabili gli arresti fermentativi.
Uno dei motivi è il fatto che a basse torbidità il lievito produce un maggiore tenore di acidi grassi a media catena, acido decanoico e ottanoico, che sono dei veri e propri inibitori della fermentazione. Ammetto che in letteratura enologica, pur essendo in vari articoli citato il fatto che l’acido decanoico è dannoso per il lievito, non vi è molta chiarezza sulla via metabolica che porta alla formazione di questo acido.
Ma, essendo rilevato il fatto che esso viene formato maggiormente in mezzi molto limpidi, è ipotizzabile che il lievito in tali condizioni abbia minori mattoni per costruire acidi grassi a lunga catena (C16, C18), e si fermi quindi ad acidi a soli 6, 8 o 10 atomi di carbonio. Gli acidi grassi prodotti dal lievito hanno sempre un numero pari di atomi di carbonio, proprio perché il lievito tramite il Coenzima A aggiunge degli acetili, ovvero 2 carboni alla volta.
Gli acidi grassi a corta catena sono:
C2, acido acetico o etanoico
C4, acido butirrico o butanoico
C6, acido esanoico
Gli acidi a media catena sono:
C8, acido ottanoico
C10, acido decanoico
C12, acido dodecanoico.
In conclusione l’obbiettivo enologico deve essere quello di favorire la produzione di acidi grassi a lunga catena, con una discreta percentuale di acidi grassi insaturi, che migliorano il funzionamento della membrana cellulare.
E’ auspicabile che ulteriori studi vengano svolti in questo campo.
AZOTO ALFA AMMINICO E INTEGRAZIONE CON SALI AMMONIACALI
Un tema importante quando si dà principio ad una fermentazione è il tenore di azoto disponibile per il lievito presente nel mosto (APA = azoto prontamente assimilabile; YAN in inglese): l’APA è dato dall’azoto alfa amminico e dall’azoto ammoniacale: in letteratura si considera necessario un tenore di APA pari a 200 mg/L espresso come azoto atomico (N); nei vini a carattere fruttato è preferibile un tenore prossimo a 250 mg/L. Nei vini tiolici il tenore in APA ideale è addirittura superiore a tale soglia. La parte alfa amminica è solitamente il 60 – 70% dell’APA, mentre la parte ammoniacale è circa il 30 – 40%. Quindi su un con APA pari a 200 mg/L di azoto (N) avremmo 130 mg/L di azoto alfa amminico e 70 mg/L di azoto ammoniacale.
Il tenore in azoto alfa amminico è di fondamentale importanza per lo sviluppo di molti metaboliti da parte del lievito.
I mosti che derivano da uve esposte al calore e alla siccità hanno un basso tenore in azoto alfa amminico, che decresce quando il grado alcolico potenziale supera i 13%; si può affermare che un tenore in azoto alfa amminico inferiore a 80 mg/L sia fortemente insufficiente ai fini di un corretto profilo aromatico. È possibile integrare l’azoto alfa amminico con prodotti enologici (derivati di lievito), ma ai normali dosaggi (20 – 40 g/hL) l’effetto è di portare un incremento molto modesto (si possono fornire nella migliore delle ipotesi 20 mg/L). Nel caso in cui ci sia una forte carenza di azoto alfa amminico, la sola aggiunta di derivati di lievito non permetterà di sfuggire al rischio di fenomeni riduttivi.
Tali fenomeni riduttivi occorrono quando il lievito decompone tutti gli amminoacidi (alfa amminico diviene pari a zero): in questa fase il lievito utilizza completamente gli amminoacidi solforati, al fine di ottenere amminoacidi più semplici, come l’alanina, che è un amminoacido dal quale il lievito può creare altri amminoacidi più complessi utili al suo metabolismo.
Dalla decomposizione degli amminoacidi solforati si libera nel vino l’idrogeno solforato ed il metantiolo (odore di uovo marcio, aglio), con effetti negativi sulla componente aromatica del prodotto.
Si può ovviare a questo rischio aggiungendo azoto sotto forma ammoniacale, come il fosfato diammonico, o il solfato ammonico.
In linea di massima però una aggiunta di questi sali è sempre rischiosa se non si monitora il tenore di azoto ammoniacale durante la fermentazione alcolica. Potremmo dire che la regola è che non deve esserci mai azoto ammoniacale residuo a fermentazione ultimata. È bene notare che l’azoto ammoniacale viene utilizzato dal lievito solo quando il tenore in zuccheri è maggiore di 60 g/L: è dunque sbagliato fare aggiunte di azoto ammoniacale (sali) al di sotto di questo livello.
Al fine di ottenere vini puliti è consigliabile fare piccole aggiunte di sali, monitorando il consumo dell’azoto ammoniacale. I sali vanno aggiunti quando l’azoto alfa amminico è sotto i 20 mg/L e l’azoto ammoniacale è a zero mg/L. Se alla fine della fermentazione rimane un tenore di azoto ammoniacale superiore ai 20 – 30 mg/L è alto il rischio della formazione di urea, molecola che è un precursore del carbammato di etile. Questo composto è assolutamente negativo per la salute e quindi va scongiurata la sua presenza nel prodotto immesso in commercio.
In conclusione: la siccità ricorrente e le estati sempre più calde rendono le uve non irrigue molto zuccherine, povere in APA e povere in acido acido L-malico che può arrivare sotto 1 g/kg uva in varietà come il Pinot Grigio e Nero, nonché il Merlot; il lievito deve essere supportato con un dosaggio sempre maggiore di sali ammoniacali (meglio se tiaminati), poiché è impossibile (e antieconomico) fornire tenori importanti (60 – 100 mg/L di N) con l’aggiunta di estratti di lievito (servirebbero teoricamente 100 g/hL!)
Si osserva a questo punto uno squilibrio tra la fonte alfa – amminica e la fonte ammoniacale (NH4+): quest’ultima diviene maggioritaria, mentre dovrebbe essere minoritaria. Ecco che uve critiche daranno vini con una aromaticità minore, poiché l’azoto ammoniacale non fornisce aromi, mentre l’alfa amminico produce esteri acetici o alcoli aromatici (es il beta-fenil-etile).
Quindi è necessario comprendere come il prodotto enologico può dare una mano ad evitare fenomeni riduttivi o arresti fermentativi, ma solo il monitoraggio dell’azoto alfa amminico già sulle uve può darci un’idea del potenziale quadro aromatico delle uve.
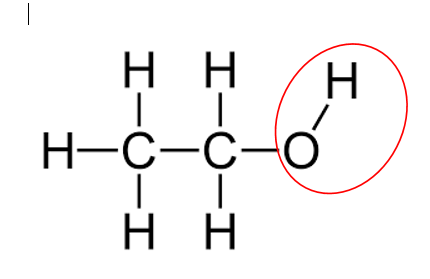
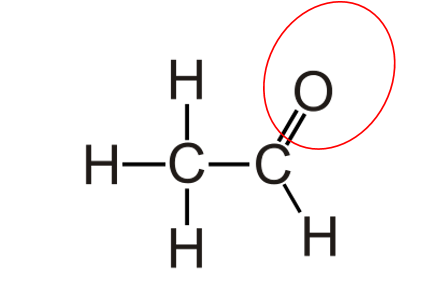
Etanolo ed etanale
Conoscere le proprietà dell’alcol etilico (etan-olo) è di fondamentale importanza, essendo questo il principale composto presente nel vino dopo l’acqua. In questo articolo vogliamo studiare le proprietà chimiche dell’etanolo e osservare come esso sia particolarmente correlato con un composto alquanto sgradito e tristemente noto agli enologi, ovvero l’acetaldeide (nome scientifico: etan-ale). Di seguito riportiamo le caratteristiche chimiche di questi composti, analizzando le formule di struttura.
Etanolo. È una molecola parzialmente alifatica (apolare), con una componente polare sull’OH; è definibile come una acido estremamente debole, in quanto l’anione corrispondente non delocalizzerebbe l’elettrone a causa della coda apolare. La pKa è pari a 15,9.
Etanale. È una molecola parzialmente alifatica (apolare), con una componente polare sull’O; è definibile come una acido estremamente debole, in quanto l’anione corrispondente non delocalizzerebbe l’elettrone a causa della coda apolare. La pKa è pari a 13,6.
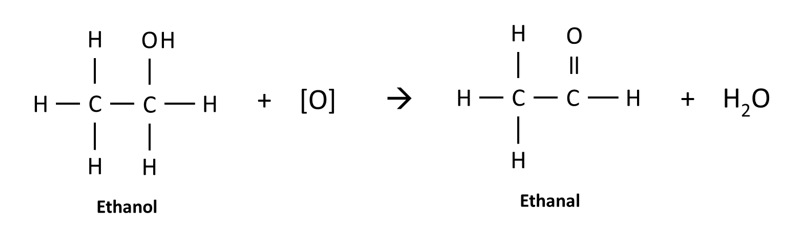
L’etanolo si ossida ad etanale per addizione di un ossigeno ed eliminazione di una molecola d’acqua
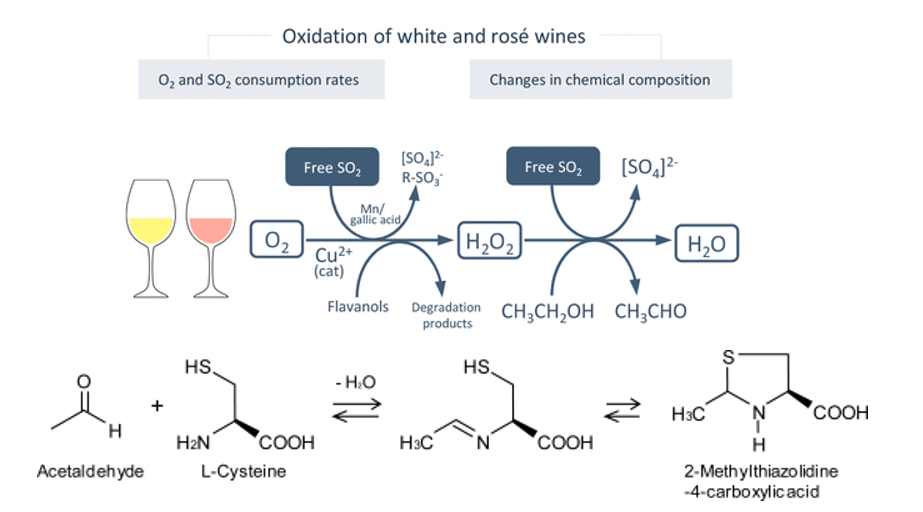
L’etanale a sua volta lega lo ione bisolfito
A livello della fermentazione alcolica una aliquota di acetaldeide si lega con lo ione bisolfito. Per questo motivo, maggiore è la quantità dai anidride solforosa contenuta nel mosto in fermentazione e maggiore è la quantità di acetaldeide prodotta. Per questo motivo è di vitale importanza non aggiungere solfiti durante la fase fermentativa, pena la formazione di acetaldeide e acido piruvico
La presenza di ossigeno, rame e flavonoli (ad esempio catechine), catalizzza l’ossidazione dell’etanolo in etanale, per mezzo della forma chimicamente attiva dell’ossigeno, che è l’acqua ossigenata (H2O2).
L’acetaldeide può essere inattivata dagli amminoacidi solforati (naturalmente presente nei lieviti e nei loro estratti) andando a creare un addotto stabile che non può essere legato all’anidride solforosa mantenendo intatto il tenore in solforosa libera.
Composti C6 a insaturazione coniugata con elettropositività sul carbonio 3
Spesso in enologia vengono trascurati alcuni composti secondari che possono invece essere di grande impatto sul profilo sensoriale del vino: i composti a 6 atomi di carbonio sono ubiqui nel mondo vegetale, basti pensare all’odore pungente dell’erba mentre viene tagliata o all’odore che si libera dalle pigiatrici al momento dell’ammostamento.
Le bucce delle uve contengono cellule integre, e tanto più bassa è la maturazione delle uve, tanto è maggiore l’aliquota di tali cellule. Ogni cellula contiene una vasta rete di membrane che compartimentano sia la cellula nella sua integrità, sia gli organuli che la cellula utilizza per le proprie funzionalità.
Se le uve sono poste in macerazione quando il pH del mosto è 2,80, enormi quantità di membrane vengono scomposte liberando proteine, steroli e trigliceridi. Le proteine decomponendosi, danno origine a fonti azotate utili per il lievito; gli steroli parimenti vanno a migliorare la funzionalità delle membrane dei microorganismi responsabili della fermentazione.
Se un uva viene pressata in modo soffice e immediatamente flottata, come è d’uso presso molti enopoli, tutte queste molecole non vengono trasmesse al mosto: ecco perché i mosti flottati, specialmente a bassa torbidità sono poco espressivi e non trasmettono i caratteri varietali; inoltre i vini che ne derivano non sono longevi a bassi tenori di solfiti.
Se invece le bucce dopo la pigiatura, e senza alcuna aggiunta di solfiti, vengono macerate a pH 2,80 e temperatura prossima ai 2°C, in atmosfera inertizzata con anidride carbonica, parecchi processi positivi hanno luogo.
I trigliceridi liberano, tramite l’ausilio delle lipasi, gli acidi grassi insaturi. I punti di insaturazione degli acidi grassi insaturi sono sui carbonii 9, 6 e 12: l’acido grasso che ha tutte e tre queste insaturazioni è l’acido alfa-linolenico. Dall’acido alfa linolenico, per idrolisi si ottiene un composto aldeidico a 6 atomi di carbonio in cui il doppio legame in C3 - C2 è coniugato con il doppio legame in C1-O (ossigeno) [E-2-Hexenal]. E’ noto che in questo caso l’atomo elettronegativo, l’ossigeno, richiama gli elettroni lungo la linea dei doppi legami coniugati, lasciando una parziale carica positiva sul C3. Questa parziale carica positiva si presta agli attacchi nucleofili da parte di molecole elettronegative: tra queste ha interesse particolare lo zolfo, sempre presente in tracce nelle uve, sia come solfuro, sia come zolfo minerale che in condizioni riducenti porta alla formazione dell’H2S; la parziale carica negativa dello zolfo permette l‘associazione in forma covalente al carbonio C3 del composto aldeidico [E-2-Hexenal], derivato dalla lisi dell’acido alfa-linolenico. Ecco che in fase prefermentativa si ha una via biochimica per creare composti tiolici di interesse, composti che poi saranno modulati dal lievito, ottimizzando il biochimismo con l’azione dei seguenti fattori:
1) Assenza di SO2 sopra i 30 ppm.
2) pH inferiore a 2,90
3) Alta torbidità (maggiore 200 NTU)
4) Alta dotazione in azoto alfa-amminico (< 120 mg/L).
Solforosa e pH
Solforosa e pH
La mia esperienza mi ha insegnato che l’anidride solforosa viene utilizzata male specialmente nelle prime fasi della vinificazione. Le uve maturano con clima sempre più caldo e sulla pruina si selezionano specie microbiche termofile. Questi nemici del vino amano sempre i pH alti. Addizionare 10 g/quintale di metabisolfito al momento della pigiatura sarebbe completamente inutile se non fosse anche dannoso per la salute del consumatore.
L’anidride solforosa estrae tannini e catechine dalle bucce bianche, che poi andranno asportati con chiarifiche, abbassando la qualità del prodotto. Sostituire alla solforosa additivi quali i tannini o l’acido ascorbico è un palliativo che può mettere a posto la nostra coscienza ma non sistema la situazione microbiologica. Solamente l’acidificazione dei mosti può porre una efficace barriera contro i batteri lattici e lieviti non Saccharomyces (tra cui Brettanomyces).
Saccharomyces cereviasiae può lavorare molto bene senza presenza di solfiti nel range di pH tra 2,90 e 3,10, dove le specie nocive si non riescono a sviluppare.