Stechiometria della trasformazione del glucosio e resa alcolica del vino
Quanto alcol si può ottenere dalla fermentazione del glucosio e del fruttosio?
Comprendere la stechiometria della fermentazione alcolica è essenziale per stimare la resa in etanolo a partire dagli zuccheri presenti nel mosto.
In questo articolo analizziamo in dettaglio le trasformazioni biochimiche del glucosio, la produzione di sottoprodotti come il glicerolo, le variazioni di peso e volume della massa fermentata e, infine, le condizioni che influenzano il grado alcolico finale del vino.
Un approfondimento tecnico-divulgativo per enologi, tecnici di cantina e appassionati di fermentazione.
Glucosio, fruttosio e glicolisi: le basi chimiche della fermentazione
Il D-(+)-glucosio e il D-(-)-fruttosio sono i principali zuccheri presenti nel mosto. Il loro peso molecolare è equivalente, infatti possiamo definire questi due composti come isomeri (molecole con stessa composizione in atomi ma differente disposizione degli atomi nella molecola).
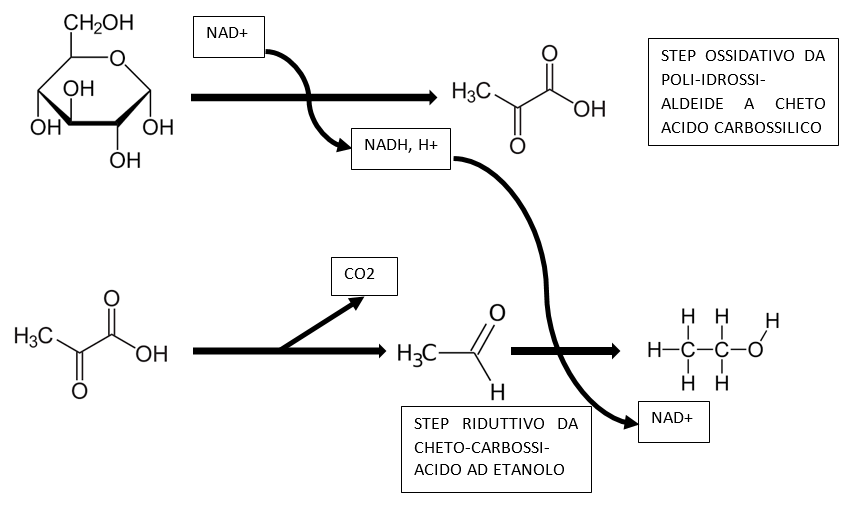
Il D-(+)-glucosio rappresenta la fonte energetica per lo sviluppo di innumerevoli forme di vita, dai microorganismi unicellulari fino ai mammiferi: è il substrato energetico per eccellenza e la sua combustione necessita di tre passaggi, di cui il primo, universale in biologia, è la glicolisi (lisi del glucosio); tale reazione comprende anche il fruttosio, in quanto isomero. Nell’immagine sottostante la formula di struttura del D-glucosio.
Sia il D-(+)-glucosio che il D-(-)-fruttosio hanno formula bruta C6H1206, il loro peso molecolare è 180 dalton, perciò una mole pesa 180 g.
La glicolisi trasforma il D-(+)-glucosio e il D-(-)-fruttosio (G + F) in acido piruvico, con una reazione ossidativa (aldeide → acido carbossilico), determinando la riduzione del coenzima NAD+ a NADH,H+.
Il successivo utilizzo dell’acido piruvico differisce tra i microorganismi dotati di mitocondri e i microorganismi in cui i mitocondri sono assenti oppure inibiti dall’effetto Crabtree (è questo il caso di Saccharomyces cerevisiae nel mosto); in questo secondo caso l’acido piruvico non aziona il ciclo di Krebs, via acetil-CoA, e dunque non vi è una ulteriore produzione di NADH,H+.
Solo se sviluppato in un mezzo molto povero in glucosio (< 9 g/L) e con grande abbondanza di ossigeno il lievito attiva il metabolismo respiratorio nei mitocondri. Nel mosto, in cui G + F sono superiori ai 180 g/L è impossibile, a prescindere dalla quantità di ossigeno fornita, che il lievito abbia un metabolismo respiratorio; di conseguenza il NADH,H+ che si forma nella ossidazione del glucosio (una poli-idrossi-aldeide) ad acido piruvico (un cheto-acido carbossilico), deve essere riossidato a NAD+ per riduzione dell’etanale ad etanolo, come mostrato nella figura sottostante.
Dalla glicolisi all’etanolo: la resa fermentativa del glucosio
La riduzione dell’acetaldeide (etanale) ad etanolo è necessaria al lievito per ripristinare il NAD+ necessario allo svolgersi della glicolisi; per il lievito l’unico modo per ottenere energia è la glicolisi, che per ogni mole di D-(+)-glucosio ossidata a piruvato produce 2 moli di ATP.
Perciò l’acido piruvico viene decarbossilato, con produzione di CO2, ad acetaldeide, che può quindi essere ridotta ad alcol etilico (etanolo).
Sulla base della stechiometria di questa reazione possiamo calcolare la resa fermentativa da glucosio ad alcol etilico.
Calcolo della resa in alcol: peso vs. volume
Un mezzo contenente una mole di glucosio (180 g/L) produce per via fermentativa due moli di
etanolo (92 g/L).
La resa in alcol espressa in peso perciò è: 92 g / 180 g = 51%
Dato che l’alcol etilico, per convenzione, è espresso in volume su volume (v/v) il suo peso, va trasformato in volume, dividendolo per la sua massa volumica a 20°C, ovvero 0,789 g/mL.
92 g /(0,789 g/mL) = 92/0,789 mL = 116,6 mL
Da cui si ha la resa da glucosio in peso ad alcol etilico in volume: 116,6 mL / 180 g = 65%
Glicerolo e sottoprodotti della fermentazione
Un mosto con un tenore di G+F pari a 200 g/L dovrebbe produrre un vino con 130 mL/L di alcol etilico. Ma da G+F il lievito produce una lunga serie di metaboliti secondari, di cui il glicerolo è il più importante: il glicerolo può variare da un minimo di 2 g/L (in questo caso modificando di poco la resa teorica del 65% in P/V) sino a un massimo di 12 g/L (con forte abbattimento della resa in alcol, come poi vedremo).
Variazioni fisiche: peso specifico e volume
Mutazione dei parametri fisici durante la trasformazione del glucosio in alcol
Esaminiamo una soluzione contenente acqua deionizzata e 200 g/L di G+F; rispetto all’acqua i due soluti hanno un peso specifico nettamente superiore:
Peso specifico del glucosio = 1,56 g/mL
Peso specifico del fruttosio = 1,69 g/mL
Considerando una media tra i due abbiamo un valore di 1,625 g/mL Il volume occupato dal soluto, (G+F) è dunque pari a:
200 g/1,625 g/mL = 123 mL (cm3)
Il volume occupato dal solvente (l’acqua) è: 1000 mL – 123 mL = 877 mL
Con la fermentazione alcolica gli 877 mL di acqua non vengono coinvolti mentre i 123 mL (200 g) di G+F si trasformano in 130 mL di alcol etilico.
Con la fermentazione alcolica si ha dunque una forte perdita di peso, dato che un composto ad alto peso specifico (G + F) viene trasformato in un composto a basso peso specifico (etanolo).
Ma ora vedremo come a questa perdita di peso non corrisponda una perdita di volume.
Calcolo finale: da mosto a vino
Calcolo della variazione di volume in una fermentazione di un mezzo con 200 g/L DI G+F
Volume G+F = 200 g/1,625 g/mL = 123 mL
200 g di G+F producono 130 mL di alcol etilico
(130 – 123) mL = + 7 mL
In teoria partendo da 1 litro di soluzione a 200 g di G+F si dovrebbero ottenere 1,007 litri di
soluzione idroalcolica.
La reazione però non è stechiometrica in quanto circa 7 g di glicerolo sono prodotti al posto dell’alcol. La quantità di alcol etilico prodotta realmente sarà dunque:
(102 – 7) g = 95 g di alcol etilico effettivamente prodotti
Possiamo affermare, pur con un certo margine di errore:
Volume G+F = 123 mL
Volume alcol effettivo = 95 g/ (0,789 g/mL) = 120 mL di alcol etilico
a cui vanno sommati:
7 g/(1,26 g/mL) = 5,5 mL glicerolo
Il volume finale del fermentato sarà dunque la somma dei volumi di acqua, alcol etilico e
glicerolo; dunque:
1000 mL (soluzione zuccherina a 200 g/L) – 123 mL (G+F) = 877 mL (acqua)
877 mL (acqua) + 120 mL (alcol etilico) + 5,5 mL (glicerolo) = 1002 mL
Possiamo affermare che la variazione di volume per fermentazione di G+F sia perciò trascurabile. Ovviamente in biologia le regole matematiche non sono applicabili al cento per cento. La resa in glicerolo può essere più bassa o più alta. Se la resa è più bassa di 7 g/L allora si avranno più grammi di alcol e perciò un maggiore volume alcolico finale.
Un ceppo con una fermentazione molto pura darà da 200 g/L di G+F un tenore alcolico prossimo a 13%; un ceppo con una fermentazione molto ricca in sottoprodotti darà un tenore alcolico prossimo a 12%; nel caso (peraltro raro) vi fosse una produzione da parte del lievito di 12 g/L di glicerolo avremmo:
12 g/(1,26 g/mL) = 9,5 mL glicerolo
(102 – 12) g = 90 g di alcol etilico effettivamente prodotti
90 g/(0,789 g/mL) = 114 mL alcol etilico effettivamente prodotti
Il volume della massa fermentata in questo caso rimarrebbe invariato
877 mL (acqua) + 114 mL (alcol etilico) + 9,5 mL (glicerolo) = 1000,5 mL
È lecito supporre che una fermentazione tumultuosa, possa, tramite il flusso della CO2, con temperatura di 35 - 38°C, trascinare con sé dell’alcol etilico e dell’acqua sotto forma di vapori, sottraendo volume per motivi fisici anziché chimici.
Possiamo comunque affermare con una certa tranquillità che da 1 litro di mosto si otterrà almeno 1 litro di vino, anche con le rese più sfavorevoli.
Calcolo della perdita di peso
Se il volume rimane invariato, è noto invece che con la fermentazione alcolica si ha una perdita della massa e ciò per il semplice fatto che 98 grammi di CO2 abbandonano il mezzo attraverso la fermentazione di 200 g/L di G+F.
Un litro di soluzione acquosa con 200 g/L di G+F ha un peso di: 200 g di G+F + 877 g di acqua = 1077 g/L
Il fermentato che ne deriva ha un peso di: 102 g di etanolo + 877 g di acqua = 979 g/L
Rispetto ad una soluzione idroalcolica il vino è però più complesso. Quindi non avremo 877 g di acqua, ma avremo circa 865 g di acqua e la rimanente parte di estratto. Teoricamente: (877 – 865) g = 12 g di estratto per un vino ottenuto senza il contatto con le bucce, ovvero senza la presenza di polifenoli (DO280 < 8).
Ma tale espressione matematica presupporrebbe che l’estratto abbia lo stesso peso specifico dell’acqua, mentre il peso specifico dell’estratto è nettamente superiore a quello dell’acqua, anche se non perfettamente quantificabile, poiché varia da vino a vino. Si può proporre una approssimazione a 1,4 g/mL per cui l’espressione diverrebbe:
● (877 – 865) mL = 12 mL (volume occupato dall’estratto in un vino)
● 12 x 1,4 g = 17 g (peso dell’estratto in un vino)
Il peso di 1 litro di vino può essere calcolato con questa espressione, supponendo che G+F siano completamente consumati:
● 95 g di etanolo + 7 g glicerolo + 865 g di acqua + 17 g di estratto = 984 g
Un litro di vino bianco, con un estratto molto basso (< 20g/L) peserà dunque un po’ meno di 990 g alla temperatura di 20°C.
Conclusioni: come stimare il grado alcolico da G+F
Qual è dunque la resa dal G+F?
È onestamente difficile dare una risposta. Il coefficiente del 60% che da molti è adottato risulta spesso in una sottostima del grado alcolico effettivo. Il mio consiglio è adottare un coefficiente di 0,625, per lo meno nei mosti atti a dare vini bianchi con tenore alcolico attorno ai 12,5% V/V.
Sei un professionista del settore enologico o ti occupi di consulenze in cantina? Scrivici o richiedi una consulenza dedicata!